Автор статьи: Аль-Замиль М.Х. д.м.н. профессор кафедры физиотерапии факультета непрерывного медицинского образования медицинского университета РУДН.
Грыжа межпозвонкового диска (МПД) в пояснично-крестцовом (ПК) отделе позвоночника является одной из самих частых патологий позвоночника и выявляется у 0,02% общей популяции. Чаще всего диагностируется у пациентов в возрасте от 30 до 50 лет и развивается у мужчин в 2 раза чаще, чем у женщин [4].
В 1934 году Mixter и Barr впервые описали патогенетическую основу влияния грыжи межпозвонковых дисков в развитии вертеброгенного болевого синдрома с произведением 19 операций дискоэктомии. По мнению авторов, данные их наблюдений явились основанием для того, чтобы считать грыжу межпозвонкового диска основной причиной клинических проявлений остеохондроза позвоночника, и патогенетическое лечение заключается в ее удалении [12].
В 90 –х годах с распространением компьютерной томографии и магнитно-резонансной томографии дискоэктомия получила широкое распространение и стала методом выбора для лечения пациентов с дискогенной радикулопатией. По статистическим данным в 90-х годах только в США ежегодно проводились 200000 операции по дискоэктромии [10].
Электромиограф Нейроэкспедитор МБН
Cовременная компьютерная система для проведения электромиографии и исследования вызванных потенциалов мозга
До сегодняшнего дня не прекращается дискуссия об эффективности дискоэктомии при лечении пациентов с болями в ПК отделе позвоночника. Кроме того, во многих работах описывается ряд осложнений, которые могут ухудшить течение болезни и снизить качество жизни пациентов.
У 31 пациента, после перенесенной задней поясничной дискоэктомии, было выявлено снижение кровотока в корешках от 18% до 30% в ответ на их ретракцию. Также была выявлена корреляционная связь между длительностью проведения ретракции и снижением скорости кровотока. У пациентов со сложными операциями с длительным течением развивались сенсорные и моторные нарушения в результате необратимых ишемических нарушений [8].
При исследовании 233 пациентов, прошедших эндоскопическую дискоэктомию, повреждение корешков было выявлено у 23 пациентов с развитием моторного дефицита (9,8%) [2].
Постоперационные инфекции, с последующим развитием воспалительного радикулита, развивались у 1-2 % пациентов. Более серьезное осложнение, приводящее к развитию дуротомии выявлялось у 2% пациентов. Дуротомия может привести к утечке спинномозговой жидкости с последующим риском развития менингита [1].
В литературе описываются более редкие осложнения с формированием псевдоменингоцеле с постепенной трансформацией в свищ спинномозговой жидкости с защемлением нервного корешка [9].
Важно отметить, что частота возникновения рецидивирующей грыжи МПД в ПК отделе после дискэктомии по статистическим данным доходит до 25% [6, 15] и развивается в 61,7% случаев через 6 месяцев после дискоэктомии [12].
У многих пациентов после дискоэктомии сохраняется болевой синдром в ПК отделе, что может говорить о неудачной проведенной операции. В других случаях боль может появляться через некоторое время, как результат рецидивов грыж ППД [3].
Важно отметить, что у большинства пациентов после дискоэктомии в ПК отделе, несмотря на устранение компрессии корешка, продолжаются проявления хронической радикулопатии. Болевой синдром сохраняется у 85,8% пациентов, онемение у 74,1%, и парестезия у 44,7%. [5].
Описание рассматриваемого клинического случая и результаты исследования электромиографом
Клинический случай:
Пациентка, 47 лет, в течение 6 лет страдала сильными болями в ПК отделе позвоночника. На МРТ ПК отдела позвоночника была выявлена латеральная правосторонняя грыжа МПД размером L5-S1 размером 10 мм с развитием дискорадикулярного конфликта. У пациентки спустя 3 месяца после дискоэктомии развились жалобы на болезненные судороги в правой ноге особенно в икре и в мышцах стоп усиливающиеся в ночное время.
В неврологическом статусе: умеренная болезненность при пальпации паравертебральных точек L4-S1 и в проекции задней ости крыла подвздошной кости справа.
Парезов нет. Выпадение ахиллов рефлекс справа. Выраженный симптом Ласега справа 10 гр. и слева 50 гр.
Выраженность болевого синдрома по визуальной аналоговой шкале составила 7 баллов в покое и 10 баллов при движении.
Выраженное нарушение походки и вынужденное анталгическое положение.
Снижение чувствительности зоне инннервации корешков L5, S1.
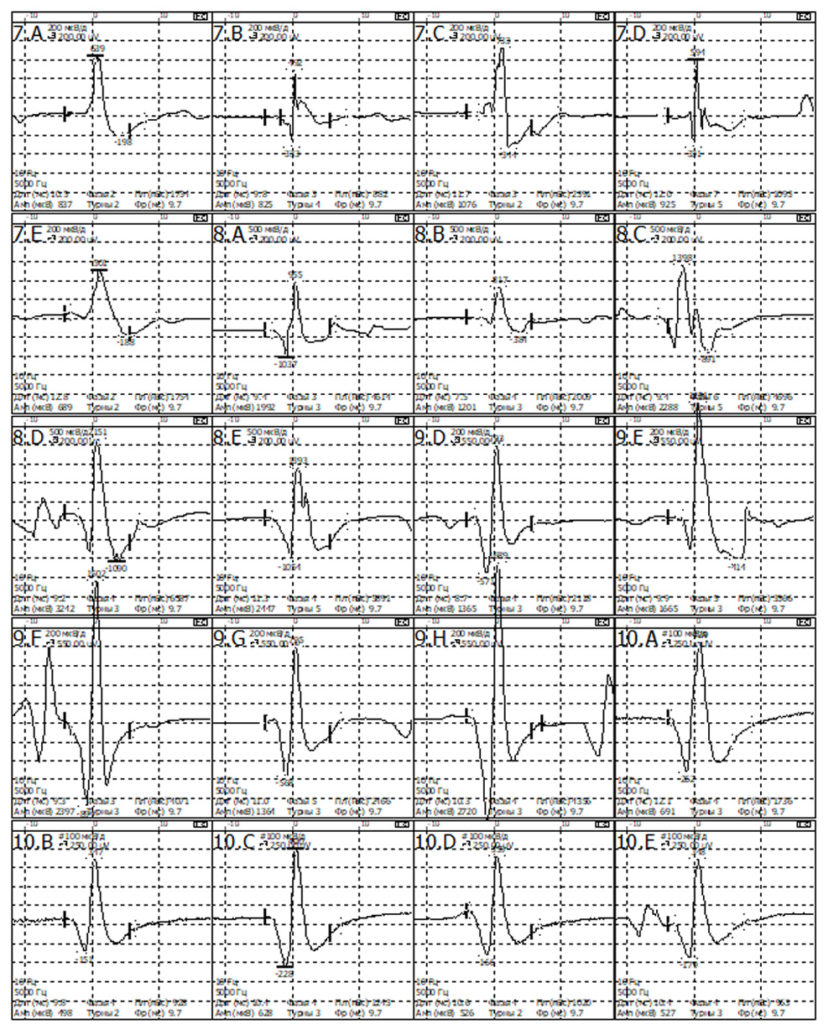
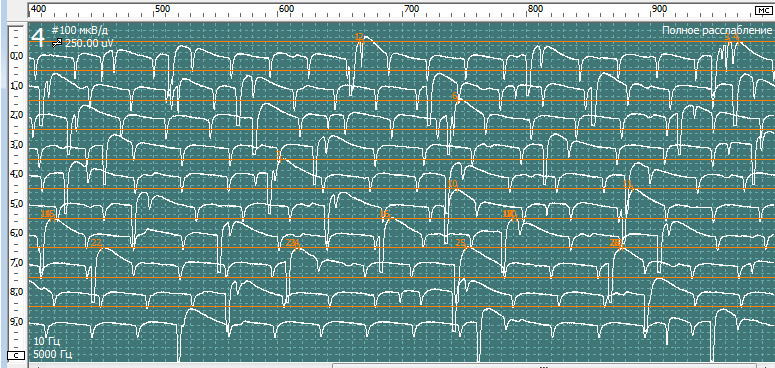
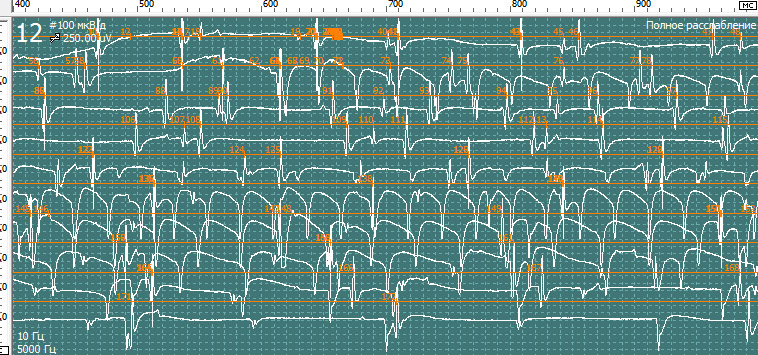
При проведении игольчатой ЭМГ выявлены признаки вторичного миотонического синдрома на фоне выраженного денервационного процесса в более выражен на уровне корешков L5 и S1 и в меньшей степени в волокнах корешка L4 справа.
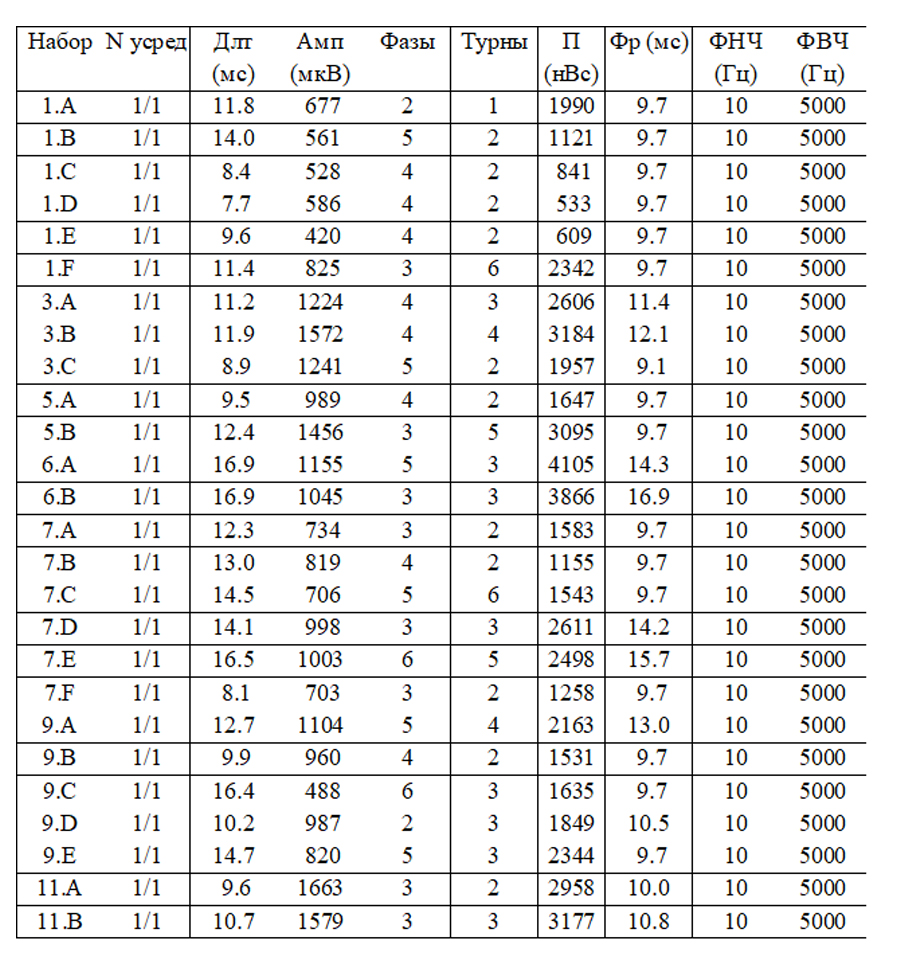
Результаты игольчатой электромиографии:
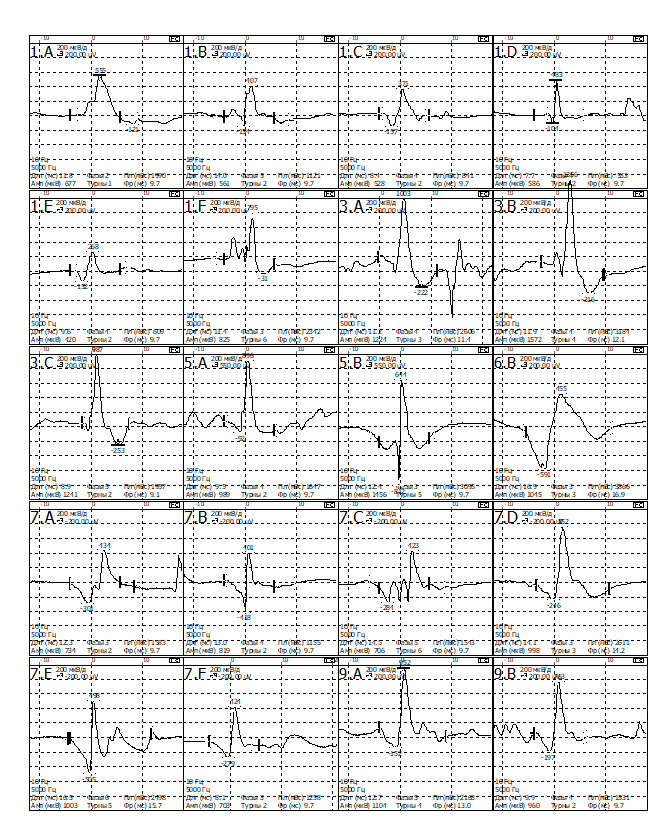
При обследовании m.para spinalis L5-S1 справа
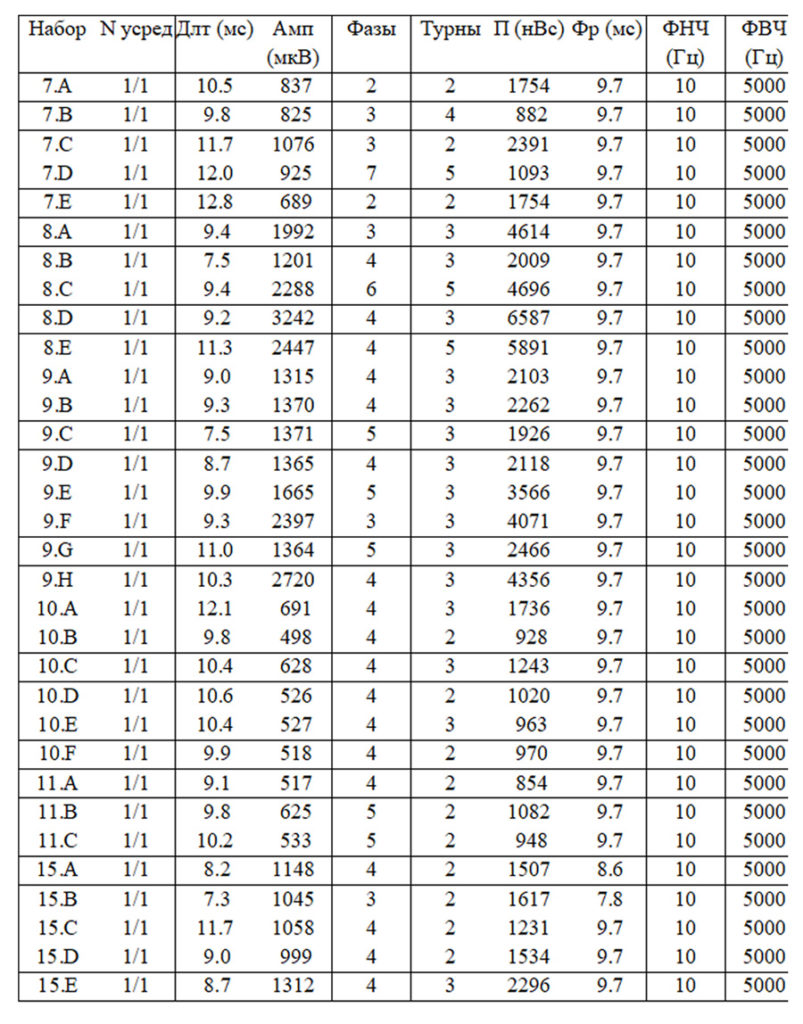
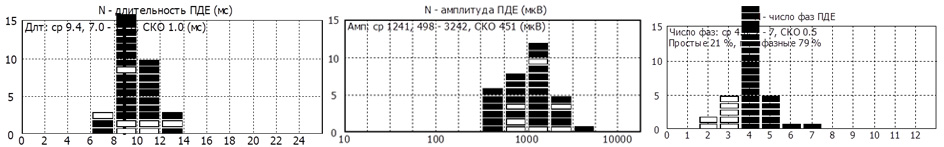
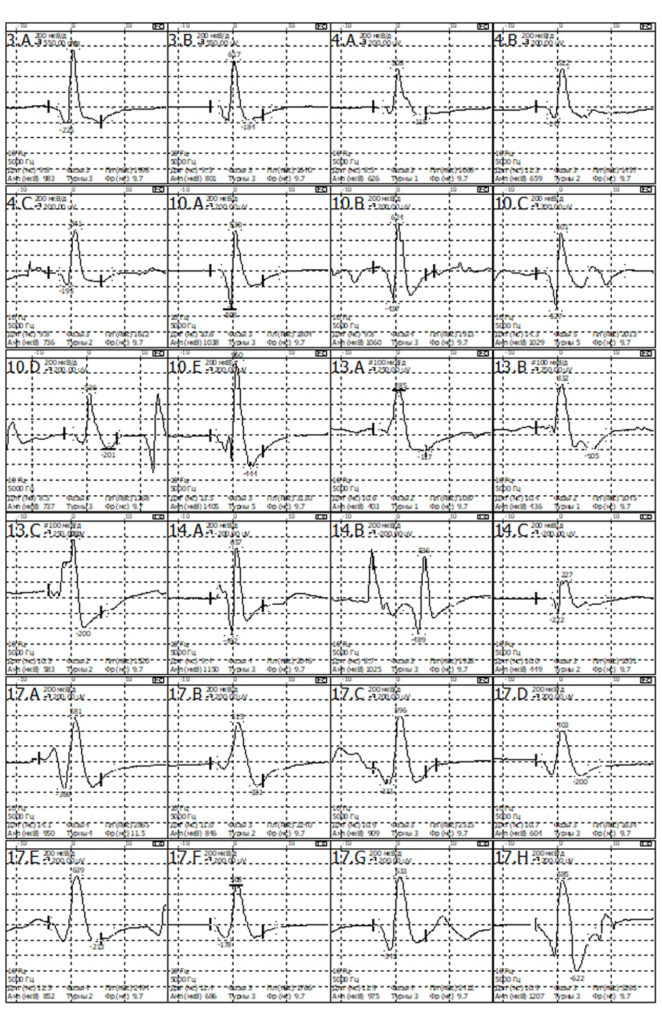
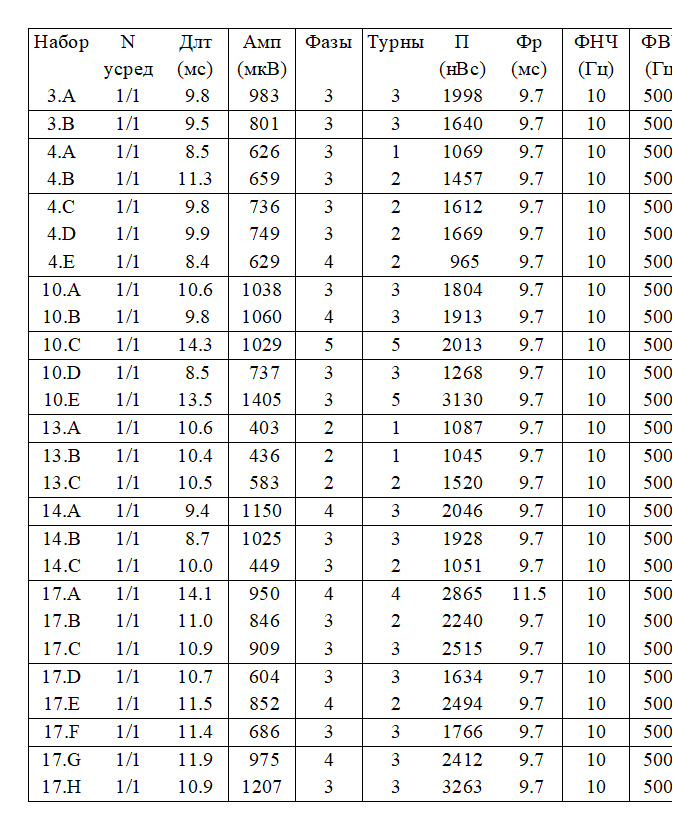
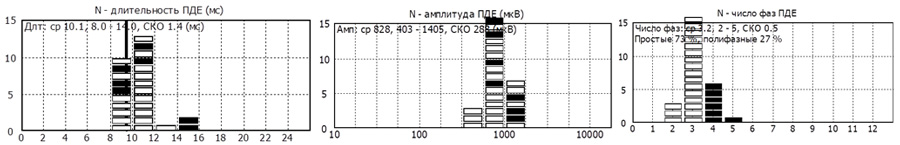
- Средняя длительность ПДЕ = 9,4 мс (норма 9,5 мс). Регистрируется диапазон ПДЕ от 7 до 12 мс (допустимое отклонение от 7,6 до 11,7 мс)
- Средняя амплитуда ПДЕ =1241 мкВ (норма в среднем = 550 мкВ)
- Максимальная амплитуда ПДЕ = 3242 мкВ (норма в среднем = 1250мкВ)
- Полифазные ПДЕ слева 79% (норма < 15%).
- Позитивные острые волны( +3) и потенциалы фибриляции (+3).
- Вторичные миотонические разряды.
- Потенциала фасцикуляции не определяется.
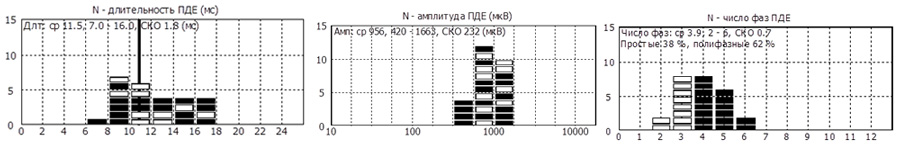
При обследовании m.tibialisanterior L4 справа
- Средняя длительность ПДЕ = 11,5 мс (норма 11,5 мс). Регистрируется диапазон ПДЕ от 7 до 16 мс (допустимое отклонение от 8,0 до 12,0 мс)
- Средняя амплитуда ПДЕ =956 мкВ (норма в среднем = 550 мкВ)
- Максимальная амплитуда ПДЕ = 1663 мкВ (норма в среднем = 1250мкВ)
- Полифазные ПДЕ слева 62% (норма < 15%).
- Единичные позитивные острые волны( +1) и потенциалы фибриляции (+1).
- Потенциала фасцикуляции не определяется.
- Единичные вторичные миотонические разряды.
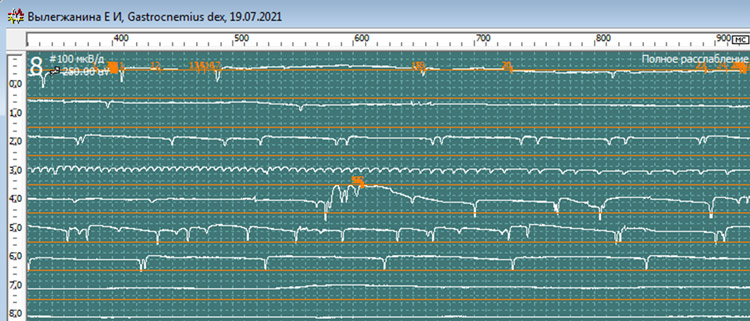
При обследовании m.gastrocnemius L5-S1 справа
- Средняя длительность ПДЕ = 10,1 мс (норма 11,5 мс). Регистрируется диапазон ПДЕ от 8 до 14 мс (допустимое отклонение от 8,0 до 12,0 мс)
- Средняя амплитуда ПДЕ = 828 мкВ (норма в среднем = 550 мкВ)
- Максимальная амплитуда ПДЕ = 1405 мкВ (норма в среднем = 1250мкВ)
- Полифазные ПДЕ слева 27% (норма < 15%).
- Позитивные острые волны( +3) и потенциалы фибриляции (+2).
- Вторичные миотонические разряды.
- Потенциала фасцикуляции не определяется.
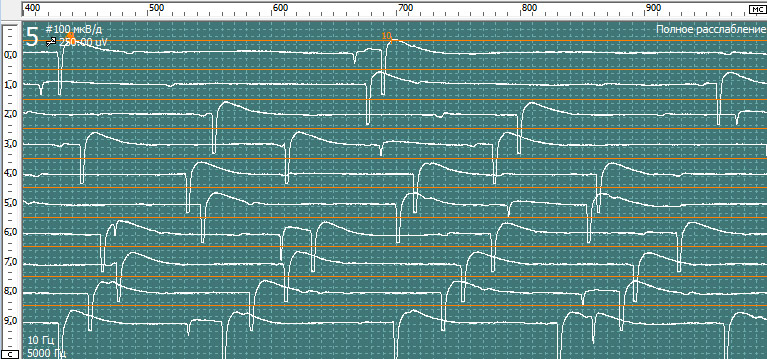
Нерв, мышца: Gastrocnemius dex (для увеличения нажмите на картинку)
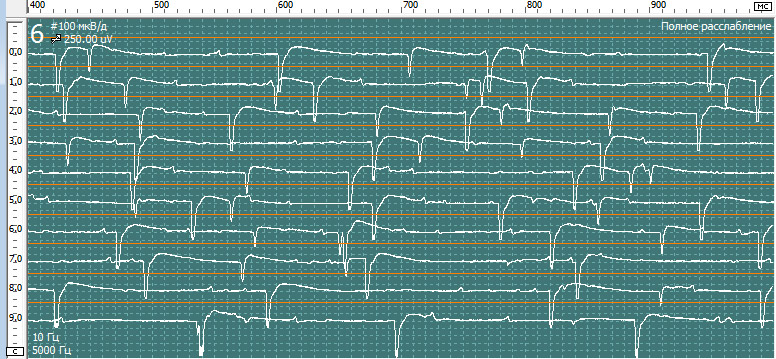
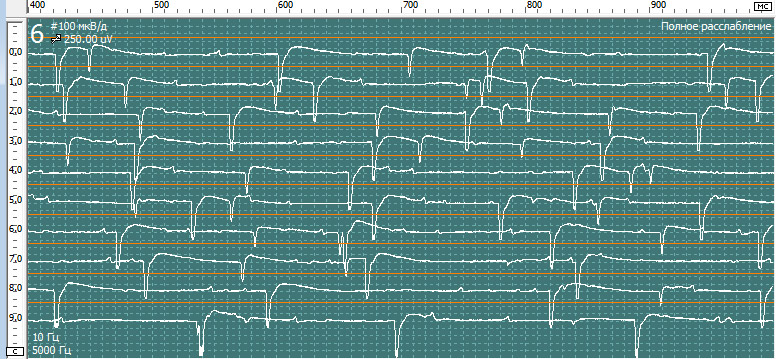
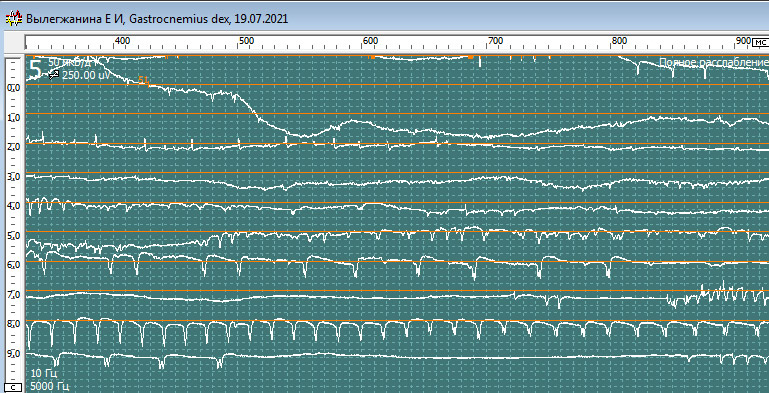
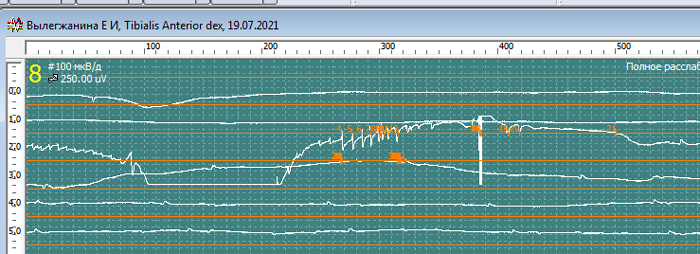
Нерв, мышца: Tibialis Anterior dex
Спонтанная активность в покое. Вторичные миотонические разряды:
Заключение после результатов исследования:
У пациентка на игольчатой эдектромиографии были выявлены признаки денервационно-реиннервационного поражения исследованных мышц IIIа стадии нейрогенного характера в результате поражения корешков L5-S2. Обращает на себя внимание выраженные признаки денервационного поражения корешка S1 справа и вторичный миотонический синдром в мышечных волокнах m.gastrocnemius и paraspinalis L5-S1 справа.
На повторном МРТ ПК отдела выявлены признаки развития осложненного спаечного процесса в корешках L4-S1.
Рекомендации по дальнейшему лечению пациента:
Необходимость проведения игольчатой электромиографии с исследованием параспинальных мышц при обследовании пациентов с подозрением на наличие дискогенного корешкового синдрома до проведения дискоэктомии и при обследовании пациентов с сохранностью болевого синдрома после проведения дискоэктомии.
Использованная литература:
- Atlas SJ, Keller RB, Wu YA, Deyo RA, Singer DE. Long-term outcomes of surgical and nonsurgical management of sciatica secondary to a lumbar disc herniation: 10 year results from the maine lumbar spine study. Spine. 2005; 15;30(8):927-35.
- Choi I, Ahn JO, So WS, Lee SJ, Choi IJ, Kim H. Exiting root injury in transforaminal endoscopic discectomy: preoperative image considerations for safety. Eur Spine J. 2013;22(11):2481-7.
- Daniell JR, Osti OL. Failed Back Surgery Syndrome: A Review Article. Asian Spine J. 2018;12(2):372-379
- Fjeld OR, Grøvle L, Helgeland J, Småstuen MC, Solberg TK, Zwart JA, Grotle M. Complications, reoperations, readmissions, and length of hospital stay in 34 639 surgical cases of lumbar disc herniation. Bone Joint J. 2019 Apr;101-B(4):470-477.
- Huang P., Sengupta D.K. How fast pain, numbness, and paresthesia resolves after lumbar nerve root decompression: a retrospective study of patient’s self-reported computerized pain drawing. Spine. . 2014 Apr 15;39(8):E529-36
- Huang W, Han Z, Liu J, Yu L, Yu X. Risk Factors for Recurrent Lumbar Disc Herniation: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016 ;95(2):e2378.
- Matsui H, Kitagawa H, KawaguchY i, Tsuji H. Physiologic changes of nerve root during posterior lumbar discectomy. Spine. 1995;15;20(6):654-9.
- Shu W., Wang H., Zhu H. 1, Li Y. Nerve root entrapment with pseudomeningocele after percutaneous endoscopic lumbar discectomy: A case report. J Spinal Cord Med. 2020;43(4):552-555
- Taylor VM, Deyo RA, Cherkin DC, Kreuter W. Low back pain hospitalization. Recent United States trends and regional variations. Spine. 1994;19:1207–1212
- Truumees E. A History of Lumbar Disc Herniation From Hippocrates to the 1990s. Clin Orthop Relat Res. 2015; 473(6): 1885–1895.
- Wera GD, Marcus RE, Ghanayem AJ, Bohlman HH. Failure within one year following subtotal lumbar discectomy. J Bone Joint Surg Am. 2008;90(1):10-5
- Yin S, Du H., Yang W., Duan C, Feng C. Prevalence of Recurrent Herniation Following Percutaneous Endoscopic Lumbar Discectomy: A Meta-Analysis. Pain Physician. 2018;21(4):337-350.